Con questo esperimento dimostreremo il fenomeno dell’elettrolisi: un processo che consiste nello svolgimento di trasformazioni chimiche grazie all’apporto di energia elettrica; si ha quindi la conversione dell’energia elettrica in energia chimica.
Attrezzature necessarie
Sono necessari(Figura 1):

-un contenitore in vetro o ceramica
-2 piastre metalliche
-2 batterie al piombo 12 V (quelle di auto e moto)
-sale da cucina(cloruro di sodio NaCl)
-acqua distillata
-voltmetro e amperometro
-filo di rame
NOTA BENE: durante l’elettrolisi si sviluppa cloro allo stato gassoso, che è un gas irritante, quindi è opportuno svolgere questo esperimento all’aperto.
Prima prova (per avere un’idea generale)
Per iniziare 1) versiamo acqua del rubinetto nel contenitore, 2) fissiamo le piastre metalliche sul contenitore una come anodo e l’altra come catodo sul contenitore, 3) colleghiamo le due batterie in serie 4) colleghiamo l’amperometro in serie (alla fine si deve avere una situazione tipo quella della Figura 2a).

1

2

3

4

figura2a
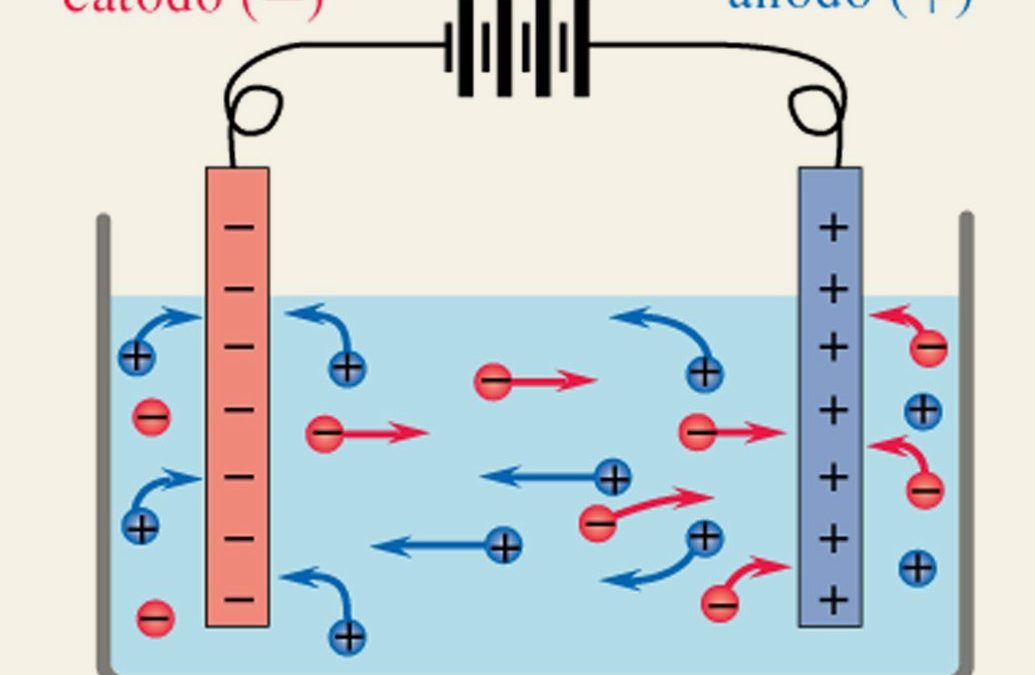
Il cloruro di sodio in acqua si dissocia in ioni Na+, che vanno verso il polo negativo e si verifica una reazione di riduzione(1), e ioni Cl–, che vanno verso il polo positivo e, qui invece, si verifica una reazione di ossidazione(2), a causa del passaggio della corrente.
(1)-Catodo Na+ + e→Na che si deposita sull’elettrodo
(2)-Anodo 2Cl– → Cl2 + 2e che si libera sotto forma gassosa.
Ribadiamo che, essendo Cl2 un gas irritante, è opportuno fare questo esperimento in un ambiente aperto.
Invece l’acqua al passaggio della corrente si scinde secondo questa equazione
2 H2O + 2 e→ 2 OH– + 2 H+
-Al catodo gli ioni idrogeno (H+) acquistano elettroni e ciò porta alla formazione di idrogeno allo stato gassoso 2 H+ + 2 e- → H2
– All’anodo, gli ioni idrossido (OH–) cedono elettroni:
4 OH– + 4 e- →2 H2O + O2 (ossigeno allo stato gassoso)
Si vede chiaramente nella Figura 2b che: al catodo (-) si formano bollicine di idrogeno, invece all’anodo(+) si formano bollicine che contengono ossigeno.
Si vede chiaramente nella Figura 2b che: al catodo (-) si formano bollicine di idrogeno, invece all’anodo(+) si formano bollicine che contengono ossigeno.

figura2b
Nota: all’inizio fra le due lamine non passava corrente, ciò accadeva perche si era formato uno strato di ossido, allora si è provveduto a rimuoverne un po’ con della carta vetrata.
Seconda prova
Dopo aver sciacquato e asciugato il bicchiere versiamo dell’acqua demineralizzata all’interno del contenitore a circa 25 gradi (temperatura ambiente)
Ci assicuriamo che vi sia la tensione in V e vediamo che lo strumento misura 24V, quindi c’è differenza di potenziale (Figura 3a).
Successivamente misuriamo l’intensità di corrente in A e osserviamo che risulta 0 (Figura 3b). In realtà si verifica un passaggio di corrente ma è una quantità irrisoria.

figura3a

figura3b
Deduciamo quindi che l’acqua demineralizzata non conduce la corrente elettrica perché non avviene la reazione di riduzione (1) e di ossidazione(2) non essendoci sali disciolti in essa.
Terza prova
All’acqua demineralizzata aggiungiamo una punta di cucchiaino di sale da cucina (Figura 4a), lo mescoliamo per scioglierlo e misuriamo l’intesità di corrente che risulta aumentata (nel nostro caso è 0.93A, Figura 4b).

figura4a

figura4b
Quarta prova
All’acqua aggiungiamo altro sale, circa un cucchiaino (Figura 5a), mescoliamo e misuriamo di nuovo la corrente, che risulta incrementata rispetto a prima (nel nostro caso la corrente aumenta fino a 3A, Figura 5b).

figura5a

figura5b
Quinta prova
Scaldiamo l’acqua facendo avvenire l’elettrolisi, che produce calore, e a circa 35 gradi lo strumento indica una corrente di 4A (Figura 6).

figura6
Conclusioni
La corrente che passa tra anodo e catodo risulta maggiore con la maggiore
concentrazione del sale in acqua (fino al limite di saturazione) e con
l’aumento della temperatura del liquido.
Mirabile lavoro svolto da Marco Cavagnetto della classe III A con la supervisione del Decano ill.mo Prof. Paolo Baracani

Commenti recenti